进展资讯
progress of information
《Molecular Cancer》:我院新药创制团队阐述新一代PROTACs的机遇与挑战
分享:
发布时间:2024-06-07
近日,我院新药创制团队邢东明、王超在国际著名学术期刊《分子癌症》(Molecular Cancer)(IF:37.3,Top期刊)上发表了题为“New-generation advanced PROTACs as potential therapeutic agents in cancer therapy”的综述,全面阐述新一代PROTACs技术的机遇与挑战。

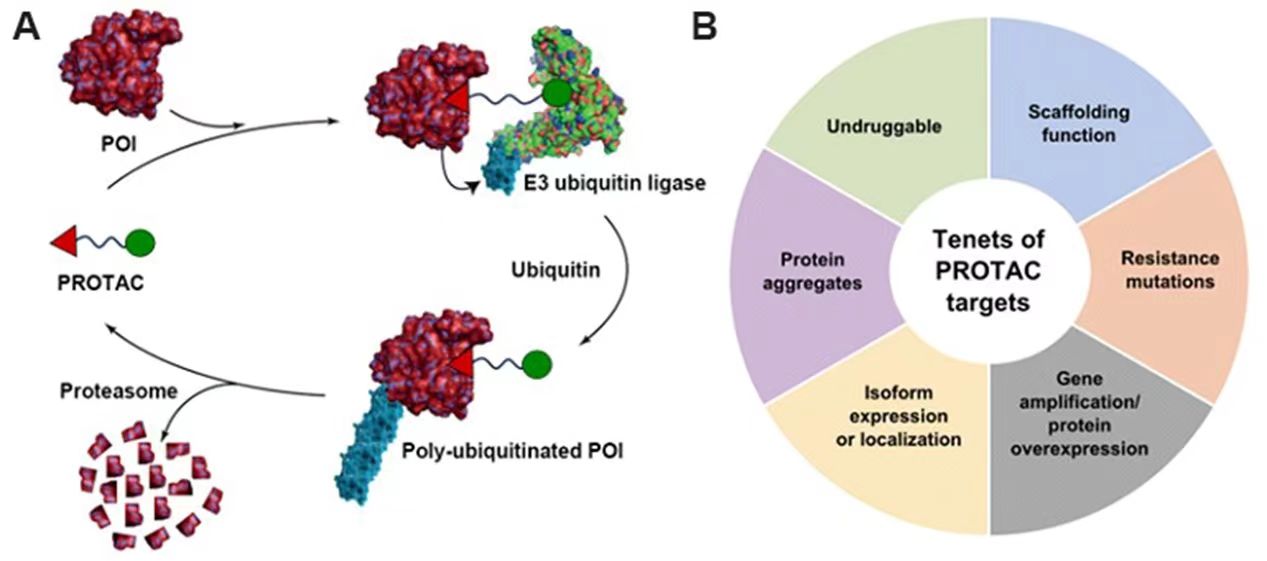
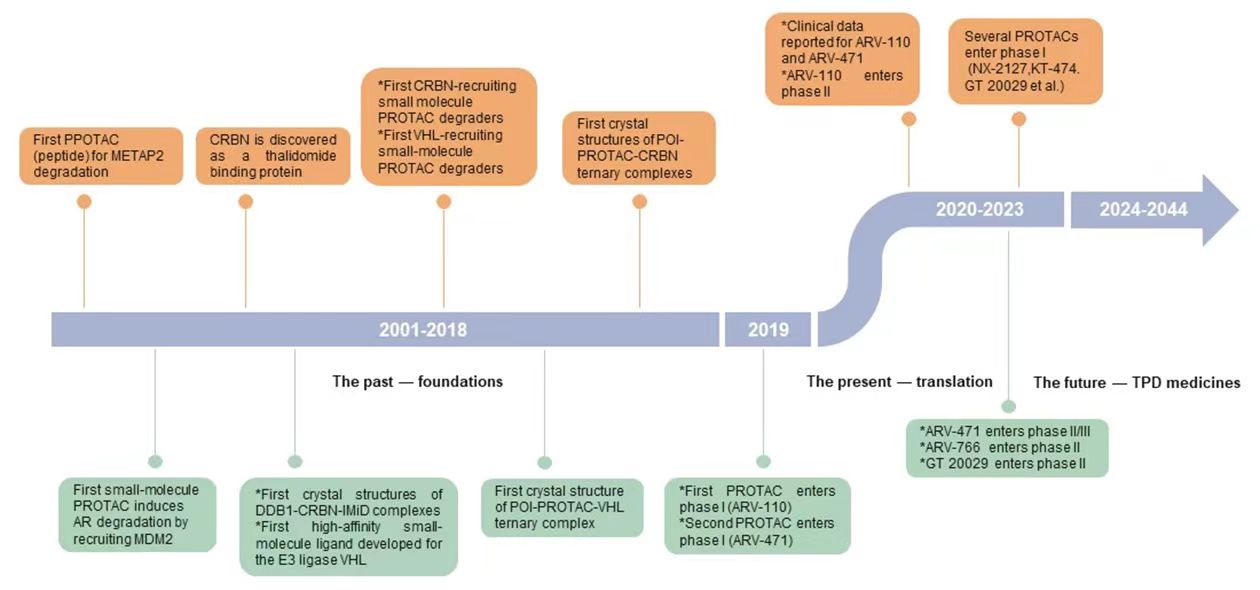
事件驱动模式:PROTACs“火”的来龙去脉
2001年靶向蛋白降解嵌合体(PROTACs)首次作为化学生物学方法和新的治疗方法被提出来,经过20年的发展,PROTACs技术已经成熟。PROTACs不同于传统的小分子抑制剂,PROTACs采用的是事件驱动(event-driven)的药理学作用模式,而非传统的小分子占据驱动模式(occupancy-driven)。PROTACs分子包括三部分,一头是靶向目的蛋白结构,另一头招募泛素E3连接酶,中间通过合适的连接体(linker)连接,通过linker将靶蛋白配体与泛素E3连接酶配体连接一起,在体内分别识别靶蛋白和泛素E3连接酶,通过诱导招募泛素E3连接酶至靶蛋白表面,引发多聚泛素化过程诱导靶蛋白降解,从而达到疾病治疗的效果。这种全新的小分子诱导药理学的途径对药物发现过程产生了深远影响。
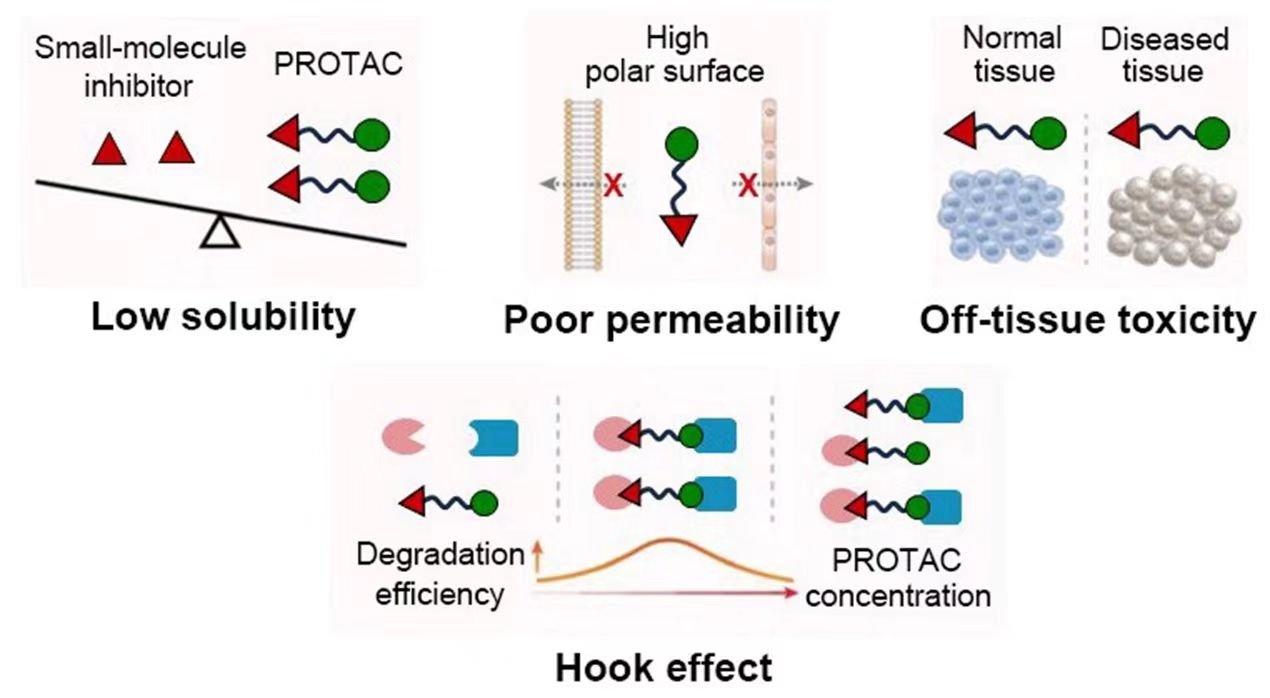
PROTACs的优点是不仅可以有效地抑制目标蛋白,还可以快速降解清除。其中一个很值得注意的一点是:只需要催化量的药物,就可以降解细胞内靶标蛋白,故具有较高的安全性、耐药性和广阔的应用前景。尽管PROTACs已表现出显著的有效性,但是仍有许多不足的地方需要解决。PROTACs是双靶点药物,所以分子量、分子刚性、水溶性都不甚理想。脱靶毒性也是大家最为担心的核心问题。传统靶向蛋白活性的小分子、大分子药物,甚至小核苷酸,一般来讲对蛋白活性的抑制不会太彻底,也多不影响骨架蛋白的表达,这样固然增加了耐药性发生的概率,但同时残留的活性也可能保障了正常细胞、组织器官基本的生理活性,降低了潜在毒性。而PROTACs 作为更为彻底靶标蛋白降解者,务必会误伤到其它脱靶蛋白,即使是以前验证过的靶点,也可能会带来更为严重的毒性,需要在未来的临床实验中密切监测。
新一代PROTACs的蓬勃发展
近年来,人们不断探索新一代PROTACs,包括小分子PROTAC前药、生物大分子-PROTAC偶联物、纳米PROTACs等。这些新一代PROTACs在特定组织中受到外源性或内源性刺激时,能够恢复降解目标蛋白的功能,而在其他部位则保持无活性。这种创新方法有望实现高度靶向治疗并减少副作用。例如,点击释放型PROTACs、酶激活型PROTACs、谷胱甘肽激活型PROTACs、缺氧激活型PROTACs、光激活型PROTACs、辐射激活型PROTACs、活性氧激活型PROTACs等。此外,新一代PROTACs还能通过优化配体(包括叶酸、抗体和适配体)选择性地靶向特定细胞。另外,在PROTACs中使用纳米药物递送系统还具有多种优势,包括增强PROTACs在病变组织中的积累和改善体内药代动力学(PK)特征。纳米PROTACs聚合物的应用就是一个很好的例子。这种创新方法为治疗各种疾病带来了全新的可能性,并有望减少药物治疗过程中产生的副作用,为临床医学带来重大突破。
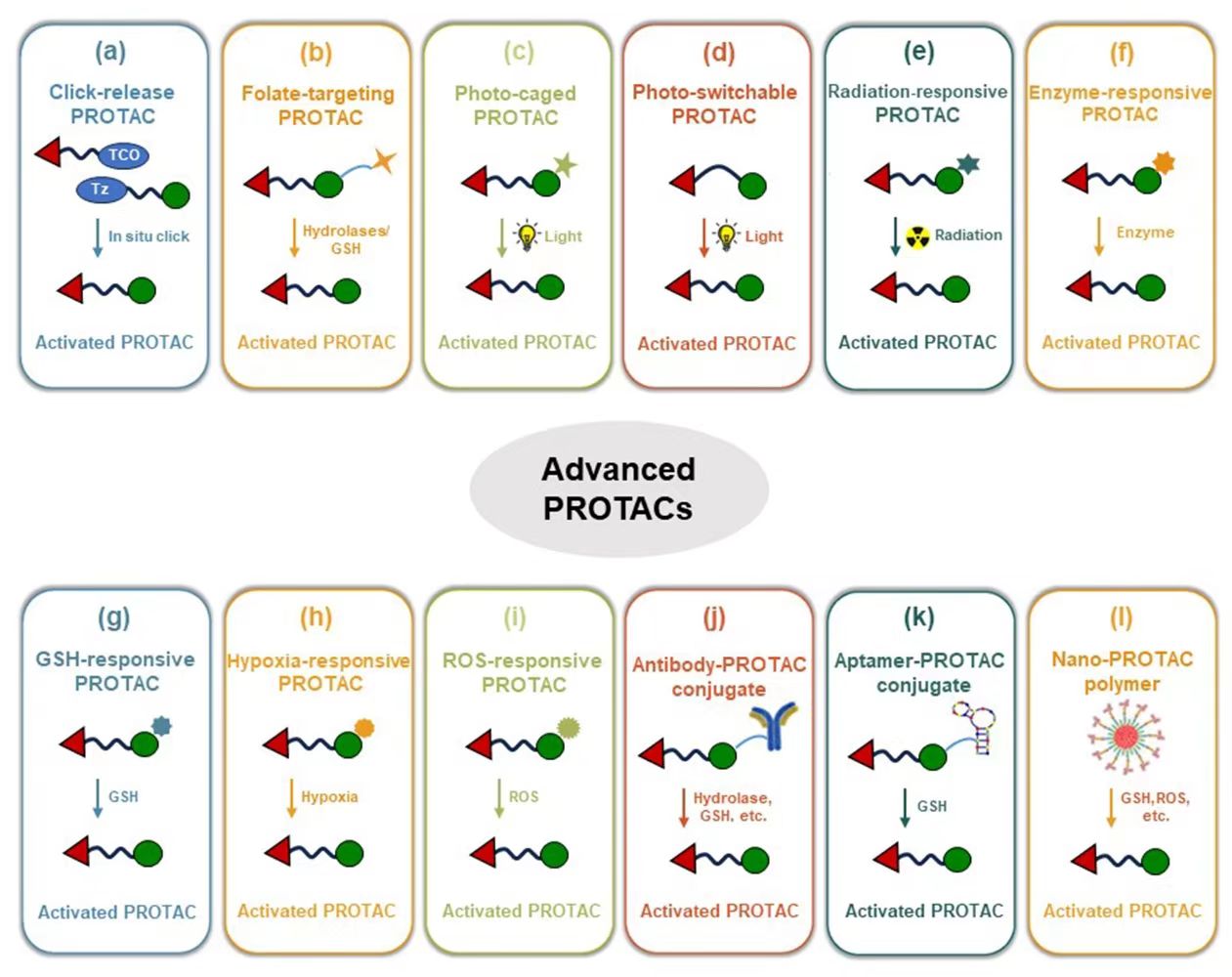
新一代PROTACs的挑战
人们通过合理设计前体配体在细胞内组装新一代PROTACs,避免了传统PROTACs分子量大的缺点。然而,由于每个单位的药代动力学特征不同,因此需要进一步考虑合适的分子比例和前体的体外反应功效。在 PROTACs分子中加入光反应掩膜可获得光激活型新一代PROTACs。然而,紫外线的组织穿透能力不足,这严重阻碍了可光激活的新一代PROTACs的开发。尽管实体瘤的内源性特征包括缺氧和活性氧水平升高也被用来激活新一代PROTACs并实现精确的蛋白降解,但原药设计需要额外的反应分子,因此不可避免地增加了新一代PROTACs的分子量,这可能会阻碍新一代PROTACs的成药性。配体修饰的新一代PROTACs具有高度的肿瘤特异性,可用于在肿瘤细胞中靶向降解目标蛋白。他们具有响应释放特性,因此有可能克服细胞渗透性差的问题,并通过将暴露限制在患病部位来减轻组织外毒性。但在设计这些配体修饰的新一代PROTACs时,还需要进一步考虑选择合适的配体、在循环中的稳定性以及内化后PROTACs的有效释放等问题。另外,基于纳米药物系统的新一代PROTACs在药代动力学、病变组织偏好和蓄积等方面都有长足进步,可在疾病治疗中起到增效减毒的协同作用。值得注意的是,大多数给药系统都不是独立的,因此它们可以相互协作,弥补自身的不足,设计出更理想的制剂。而且,各种反应机制可以整合到一个给药系统中,以实现更巧妙的可控和可预测的PROTACs释放。
尽管前景广阔,但基于纳米药物的新一代PROTACs在广泛应用时仍面临许多问题,包括但不限于所选材料的生物相容性、质量控制的可靠性和批量生产的实用性等。为方便新一代PROTACs的临床应用,外源性刺激可倾向于临床治疗中使用的方式,如超声波、放射线等。此外,优化选择病变组织的内源性标志对提高疾病特异性至关重要,这需要研究人员深入了解不同疾病的特征。此外,新一代PROTACs的给药方式对临床推广也很重要,患者更倾向于口服方式。因此,口服给药的新一代PROTACs是发展的趋势。
路在何方:新一代PROTACs的机遇与策略
新一代PROTACs通过对光、缺氧、酶、X射线、活性氧和谷胱甘肽等各种内源性或外源性刺激做出反应,实现了靶向蛋白质降解,同时将副作用降至最低。这些刺激响应式结构的主要优势之一是可以将多功能配体加入新一代PROTACs中。这样就能通过靶向特定受体(如抗体、叶酸或适配体)实现细胞选择性。通过将其与纳米药物递送系统相结合,新一代PROTACs可进一步改善PK曲线并增强肿瘤组织的蓄积。新一代PROTACs在与其他治疗方式相结合时的潜在疗效尤其令人兴奋。在临床前研究中,通过联合疗法实现的协同效应已显示出巨大的前景,可为癌症患者带来更有效的治疗。鉴于药物化学、纳米医学和材料科学的融合,新一代PROTACs的开发为在肿瘤细胞内精确降解蛋白质带来了巨大希望。这种创新方法有望实现靶向治疗策略,从而彻底改变癌症疗法。
除PROTACs外,还有其他几种新兴技术为操纵蛋白质水平提供了替代方法。例如,AUTACs和 ATTECs旨在通过自噬途径靶向降解蛋白质。这些化合物可用于选择性地清除细胞中的特定蛋白质,为研究人员提供了研究蛋白质功能的有力工具。另一种新兴技术是LYTACs,其目的是让蛋白质在溶酶体中降解。通过引导特定蛋白质进入溶酶体降解,LYTACs为研究人员提供了一种控制细胞内蛋白质水平的新方法。值得注意的是,所有这些蛋白质降解策略都依赖于与PROTACs相似的异功能嵌合体。虽然它们在推进精准医疗方面具有巨大潜力,但必须承认,在将其转化为临床应用的过程中可能会遇到挑战。脱靶效应或有限疗效等问题可能会阻碍它们的成功应用。因此,当务之急是系统地探索和评估新一代先进的PROTACs以及其他蛋白质降解剂。因此,我们不仅能加深对这些新方法的理解,还能为改进癌症以外各种疾病领域的疗法铺平道路。这一领域的不断进步无疑将有助于扩大我们的靶向治疗工具箱,最终造福全球患者。通过严谨的研究和不同学科科学家之间的合作,我们可以释放这些创新技术的全部潜力,开创个性化医疗的新时代。
青岛大学及附属医院为第一单位,王超博士为第一作者,邢东明教授为通讯作者,团队成员包括王言红、许家珍、武玉东、陈五军、修玉涛和邵迎春。团队相关研究方向得到国家自然科学基金项目、山东省高等学校青创团队项目、青岛市科技创新高层次人才团队、山东省自然科学基金项目和青岛市自然科学基金项目的资助与支持。

综述链接:
https://doi.org/10.1186/s12943-024-02024-9